理化学研究所の研究の紹介
近畿本部 化学部会(2018年7月度) 見学・講演会報告
日 時 :
2018年7月12日(木) 13:30~16:30
場 所 : 理化学研究所 生命機能科学研究センター
講演1.理化学研究所の紹介
講演者 : 川野 武弘 サイエンスコミュニケーター
1.理化学研究所について
理科学研究所(以下理研)は、1917年に産業発展のための基礎研究と応用研究を行う財団法人として設立され、昨年100周年を迎えた。当初は財団法人として設立されたが株式会社、特殊法人、独立行政法人を経て、現在は国立研究開発法人である。国内拠点は、仙台、筑波、東京、横浜、和光、名古屋、けいはんな、大阪、神戸、播磨であり、海外にも4拠点を持っている。
事業の内容は、国家戦略に基づき戦略的研究開発推進することが主たる目的であり、次の組織に分けて研究開発を行っている。革新知能統合研究センター(AIP)、数理創造プログラム(iTHEMS)、生命医科学研究センター(IMS)、生命機能科学研究センター(BDR)、脳神経科学研究センター(CBS)、環境自然科学研究センター(CSRS)、創発物性科学研究センター(CEMS)、光量子工学研究センター(RAP)、仁科加速器研究センター(RNC)、計算科学研究センター(R-CCS)、放射光科学研究センター(Spring-8、SACLA)、バイオリソース研究センター(BRC)。
全体の規模は、研究系職員だけ約3,000名、本年度の予算は954億円である。
2.理研BDRでの研究の紹介
本日見学いただいているのは、理研BDR(生命機能科学研究センター)の大阪地区である。BDRは本年4月に発足し、横浜地区、大阪地区、神戸地区、広島地区があり、全体で69研究室を擁している。大阪地区は基礎生物学の拠点として分子イメージングと計算科学を中心とした研究を行っている。
1)分子イメージング
タンパク質の挙動研究には、下村博士の発見したGFP(Green Fluorescent Protein)は欠かせないが、現在では量子ドット(注1)を使用し、量子ドットの粒子サイズによる蛍光発色特性(図1)と、一分子イメージングが出来る高精度蛍光顕微鏡を使って、生きている細胞内でのタンパク質の動きを、図2のようにマルチカラーで観察できるようになっている。
(注1)半導体を構成する原子が数百個から数千個集まった直径数ナノメートルの粒子。この粒子の中では、電子は数ナノメートル以下の微小な空間に閉じ込められるので、粒子サイズに特有な光吸収・発光特性を示す。
 図1 量子ドットの蛍光
図1 量子ドットの蛍光
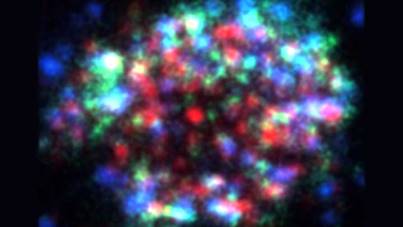 図2 タンパク質のマルチカラーイメージング
図2 タンパク質のマルチカラーイメージング
非侵襲での観察は大切である。近赤外光が皮膚を通り易いことを利用し、外部からレーザー照射することにより生体の内部を直接見る方式で、実験動物における脳血管やリンパ系を解析する研究も行っている。
2)細胞内の1分子イメージング
細胞の表面にある一つ一つの分子のライブイメージングが出来る1分子スクリーニングシステムを用いて薬剤を投与したときの受容体の動きや働きを解析している。また、改良したスピニングディスクと高速シャッター(1/100sec程度)を組み合わせることでライブイメージングが出来る超解像顕微鏡を開発した。従前は解像度が低いためよく分からなかったミトコンドリアの外膜など微小な細胞内小器官の挙動をライブで観察出来るようになった。
3)臓器・個体レベルでの全細胞イメージング
1細胞質量分析法では、細胞毎の薬剤分布を直接計測することができるようになった。また、近年、種々の遺伝子工学的手法を用いて細胞の活動状況を分子レベルで定量的に比較できるようになっている。こうした定量化技術、臓器の透明化技術(乱反射を抑え屈折を調整することで全身を透明化する)、および1細胞解像度で観察する顕微鏡技術を組み合わせると、脳などの臓器の全細胞解析が行える。これによって、眠りにCaイオン関連経路が関係していることなどを明らかにした。
4)コンピューターを使った薬の候補の絞り込みと、創薬専用スパコン
細胞丸ごとシミュレーションとして、病原性細菌であるMycoplasma genitaliumにおける、タンパク質・イオン・代謝物・水等を含む全分子について解析することで、生体システムの働きを再現出来るようになった。また、これまで述べてきた情報を総合して解析し、創薬にむけたシミュレーションを行うための分子動力学専用スーパーコンピューターも開発している。
Q&A
Q イメージングについて、抗原抗体反応ではなく架橋することで色が変わるのか。
A 量子ドットを蛋白に付けていくと考えて欲しい。なお、量子ドットのキットはあるが我々の実験の役には立たない。
Q インシリコ創薬において、候補化合物をどのようにして絞り込んでいくのか。
A 大規模な仮想化合物群の中で、構造ベースでのドラッグデザインの検討 ⇒ 受容体への結合能の検討 ⇒ 分子動力学シミュレーションによる構造解析、のように順次負荷を上げて絞り込んでいく。
Q アレルギー過敏症では受容体にフタをする考え方で絞り込んで行くと思うが、コンピューターでは何を指標にして絞り込むのか。
A 原子の座標位置であるが、量子力学的な検討までは行っていない。
文責 藤橋雅尚 監修 川野武弘



